
Introduccion
Las dos funciones del ingeniero químico son desarrollar y diseñar procesos que conviertan materias primas y fuentes básicas de energía en productos deseados o formas superiores de energía, así como mejorar y operar procesos existentes, de manera que lleguen a ser tan seguros, confiables, eficientes y económicos como sea posible.
El reto del ingeniero químico es entonces la traducción de un concepto de laboratorio a una planta comercial a gran escala.

Un proceso es una serie de acciones, operaciones o tratamientos que producen un resultado (producto). La ingeniería química se centra en operaciones como las reacciones químicas, el transporte de fluidos, la reducción y la amplificación de tamaño del equipo, la generación y el transporte de calor, la destilación, la absorción de gases, los biorreactores y demás cosas que causan cambios físicos y químicos en los materiales.

Un balance de materia para un proceso industrial es la contabilidad exacta de los materiales que intervienen en el mismo, constituyendo así la más amplia aplicación de la ley de la conservación de la masa.
Los principios de conservación
Uno de los más importantes logros de la teoría de la relatividad es la formulación del principio de la conservación de la suma de la masa y la energía de un sistema. Este principio, que constituye la base de todos los cálculos de balances de materia y energía, es una hipótesis, ya que nunca se ha demostrado de manera definitiva. Sin embargo, es una hipótesis muy sólida, ya que jamás se ha demostrado experimentalmente su falsedad.

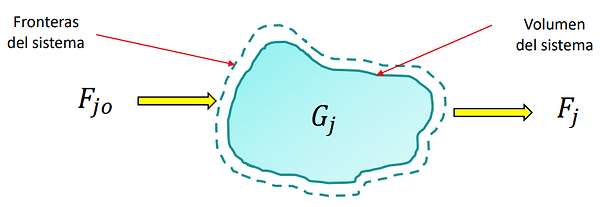
Es posible contabilizar todos los cambios en el total de la cantidad conservada que se encuentra dentro del sistema, simplemente midiendo la transferencia desde y hacia el sistema, que cruzan las fronteras del mismo. El principio de conservación de la materia y la energía se reduce a la expresión:
En ausencia de reacciones nucleares o velocidades cercanas a la de la luz, la inter conversión entre materia y energía resulta despreciable. Por lo tanto, puede separarse a la ecuación de conservación en dos expresiones:

Balance de Materia
Un balance de materia no es más que una contabilización de material. El balance de masa, puede definirse como una contabilidad de entradas y salidas de masa en un proceso o de una parte de éste. No es más que la aplicación de la ley de conservación de la masa que expresa “La masa no se crea ni se destruye”.
La realización del balance es importante para el cálculo del tamaño de los equipos de un proceso que se emplean y por ende para evaluar sus costos.


Sistema


Un sistema se refiere a cualquier porción arbitraria o a la totalidad de un proceso, establecido específicamente para su análisis. Los límites o fronteras del sistema pueden ser reales o ficticios.
Múltiples Sistemas o Unidades Múltiples
La mayoría de los sistemas de ingeniería química consisten típicamente de una secuencia de etapas de proceso. Para diseñar tales sistemas integrados por unidades múltiples se debe conocer las corrientes de entrada y salida de toda la planta, así como los flujos y componentes de todas las corrientes internas que conectan a las diversas unidades. Por tanto, también se debe considerar durante el cálculo a las etapas de procesamiento de materiales que ocurren dentro de las fronteras del sistema.
Clasificación de los procesos
Un proceso industrial puede clasificarse fundamentalmente en dos grupos:

Los procesos anteriores suelen combinarse para dar procesos semicontínuos.
Si las variables de un proceso no sufren modificación con el tiempo puede decirse que el proceso está en régimen permanente o estable. Si al contrario una de las variables cambia su valor con el tiempo se dice que el proceso es en régimen transitorio o inestable.
Diagrama de Flujo
El enunciado de un problema de balance de materia presenta en la mayoría de los casos tal complejidad que se hace necesaria una representación gráfica del mismo. En problemas sencillos el diagrama de flujo está constituido por un rectángulo u otro símbolo que representa la unidad de proceso y se utilizan flechas para indicar las entradas y salidas del mismo.

En todos los casos la información contenida se traslada al diagrama, constituyéndose éste en una gran ayuda para los cálculos de balance de masa. A medida que se avanza en los cálculos, sus resultados pueden ir colocándose en el diagrama de manera que éste proporciona un registro continuo de lo que se ha hecho y de lo que falta por hacer.
La Estequiometría
Se ocupa de la combinación de elementos y compuestos. Las relaciones que se obtienen de los coeficientes numéricos de la ecuación química son los cocientes estequiométricos que nos permiten calcular los moles de una sustancia en relación con los moles de otra sustancia que interviene en la ecuación química.

La Conversión
Es la fracción de la alimentación o de algún material clave de la alimentación que se convierte en productos.
También tiene que ver con el grado de conversión de una reacción, que por lo regular es el porcentaje o fracción del reactivo limitante que se convierte en productos.
EJEMPLO
Problema
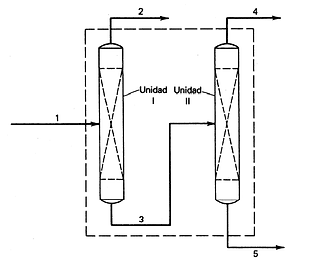
Considere un tren de separación formado por dos columnas de destilación que se han diseñado para separar una mezcla de benceno, tolueno y xileno, en tres corrientes cada una con uno de los tres componentes en composición predominante. La siguiente figura muestra el diagrama del sistema con los componentes que contiene cada corriente.
Dado un flujo de alimentación de 1000 mol/h de una mezcla que contiene 20% de benceno, 30% de tolueno y el resto xileno (todos los porcentajes en mol), en la primera unidad se obtiene un producto de fondos con 2,5% de benceno y 35% de tolueno, y un producto de destilado de 8% de benceno y 72% de tolueno en la segunda unidad. Determinar la cantidad de material que procesara cada unidad y la manera en que se divide este material entre las corrientes de salida.





El Reciclaje
Implica regresar material (o energía) que sale de un proceso, una vez más al proceso, para un procesamiento ulterior.
Un flujo de reciclaje denota un flujo de proceso que devuelve material desde un punto corriente abajo de la unidad de proceso a dicha unidad o a una unidad situada corriente arriba de esa unidad.


Una Derivación
Es un flujo que pasa por alto una o más etapas del proceso y llega directamente a otra etapa posterior

Una Purga
Es un flujo que se utiliza para eliminar una acumulación de sustancias inertes o indeseables que de otra manera se acumularían en el flujo de reciclaje

En función del tipo de industria y el nivel técnico de la unidad productiva se pueden presentar diversas condiciones para los balances de masa. El Ingeniero en Procesos debe estar preparado para resolver cualquiera de las siguientes condiciones:

EJEMPLO
Problema
Una columna se usa para separar una mezcla de tres componentes, que consiste de 7% de acetona, 61,9% de ácido acético y 31,1% de anhídrido acético. Se diseña a la columna para que produzca una corriente de fondos que no contenga acetona, y un destilado que contenga 10% de acetona y 88% de ácido acético. Si se opera a la columna de manera que se regrese como reflujo 60% del vapor desprendido por la parte superior, calcular todos los flujos suponiendo que todas las composiciones son porcentajes en mol y que se van a producir 700 mol/h de destilado.




Balance de Energía en los Procesos Industriales
Una de las tareas principales del Ingeniero Industrial al diseñar un proceso consiste en justificar con cuidado la energía que entra y sale de cada unidad de proceso y determinar los requerimientos energéticos totales de este. Para ello, recurre a escribir los balances de energía de manera muy similar a los balances de materia que se describen para explicar los flujos de masa que entran y salen del proceso y de sus unidades.
La energía total de un sistema tiene tres componentes:

Balance de Energía en Sistemas Cerrados y Abiertos
Se dice que un sistema es abierto o cerrado dependiendo de que la masa cruce o no las fronteras del sistema durante el tiempo cubierto por el balance de energía. Por definición, un sistema de proceso por lotes es cerrado, y los sistemas semicontinuos y continuos son abiertos.
La forma básica de la primera ley de la termodinámica para un sistema cerrado seria.
acumulación = entrada — salida
a) La primera ley de la termodinámica para un sistema abierto en estado estacionario tiene la forma:
entrada = salida

b) La primera ley de la termodinámica para un sistema abierto en estado no estacionario tiene la forma:
acumulación = entradas — salidas
EJEMPLOS
Problema 1
Una porción de 1 kg de una corriente de agua sale por la parte inferior de un tubo de descarga con una velocidad de 2 m/s y cae 100 metros hasta un depósito inferior. ¿A qué velocidad llega al depósito?
-
Objeto: determinar la velocidad final de la porción de agua.


Problema 2
A una tobera horizontal entra vapor a 200°C y 7bar con una velocidad constante de 60 m/s. El vapor sale a una velocidad de 600 m/s y presión reducida a 1.4 bar. Calcule la temperatura y calidad del vapor de salida.
-
Objeto: Determinar la temperatura y calidad del vapor de salida.




Instrumentación y Control de Procesos Industriales
Los procesos industriales exigen el control de la fabricación de los diversos productos obtenidos, tales como los derivados del petróleo, productos alimenticios, la industria de cerámica, las centrales generadoras de energía, la siderurgia, los tratamientos térmicos, la industria papelera, la industria textil, etc.

En los inicios de la era industrial, la operatoria de los procesos se llevaba a cabo con un control manual de estas variables utilizando sólo instrumentos simples como manómetros, termómetros, válvulas manuales, etc., control que era suficiente por la relativa simplicidad de los procesos.
SISTEMA DE CONTROL AUTOMÁTICO
Es una interconexión de elementos que forman una configuración denominada sistema, de tal manera que el arreglo resultante es capaz de controlarse por sí mismo.

En la figura se muestra un sistema de control y sus componentes básicos.

Se presentan a continuación los cuatro componentes básicos de todo sistema de control:
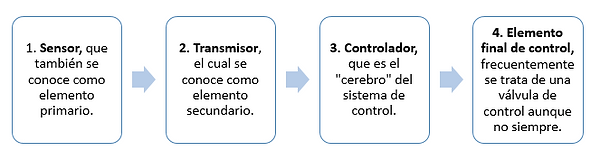
La importancia de estos componentes estriba en que realizan las tres operaciones básicas que deben estar presentes en todo sistema de control; estas operaciones son:

Estas tres operaciones, M, D y A son obligatorias para todo sistema de control. En algunos sistemas, la toma de decisión es sencilla, mientras que en otros es más compleja.
Ingeniería de las Reacciones Químicas
La Ingeniería de las Reacciones Químicas es la síntesis de todos estos factores con el propósito de diseñar el mejor Reactor Químico.

El interés de esta unidad se centra en la etapa de tratamiento químico de un proceso considerando no sólo el diseño de reactores sino también contemplando los materiales que entran y salen del sistema.

Clasificación de las Reacciones


VELOCIDAD DE REACCIÓN (-𝒓𝑨)
La velocidad de una reacción nos indica con qué rapidez se consume cierta cantidad de moles de una especie química.
Hay muchas variables que afectan la velocidad de una reacción química. En el caso de los sistemas homogéneos, la temperatura, la presión y la composición son las variables mas evidentes. En los sistemas heterogéneos hay mas de una fase, por lo que el problema se complica.
La velocidad con que se efectúa una reacción química, puede expresarse de varias maneras. Por ejemplo consideremos la reacción de Clorobenceno y el Cloral para producir el insecticida DDT (Dicloro-difenil-Tricloro etano) en presencia de ácido sulfúrico fumante .

La ecuación de velocidad es independiente del tipo de reactor, por ejemplo intermitente o de flujo continuo

ECUACIÓN GENERAL DE BALANCE MOLAR





Reactores intermitentes (Batch)
Los reactores de flujo continuo casi siempre operan en estado estacionario.
Se consideran tres tipos de reactores:

REACTORES QUÍMICOS
Reactores de flujo continuo
Es un reactor donde no existe flujo de entrada ni de salida, es simplemente un reactor con un agitador que homogeneiza la mezcla. Es esencialmente un tanque en el que se ha permitido que ocurra una reacción.
Se emplean para operaciones a pequeña escala, para probar nuevos procesos que aún no se han desarrollado en su totalidad, para fabricar productos costosos y para procesos difíciles de convertir en operaciones continuas. Este tipo de reactor se carga comúnmente por los huecos de la parte superior.

Ecuaciones de diseño para reactores intermitentes





Ecuaciones de diseño para reactores de flujo




Ecuaciones de diseño para CSTR (Reactor Continuo de Mezcla Perfecta)
Recordemos que el CSTR se representa por un modelo de mezcla perfecta, de modo que no hay variaciones espaciales dentro del reactor.


EJEMPLO
Problema
Un gas A puro a 830 kPa (8.2 atm) entra a un reactor con velocidad de flujo volumétrico, v0, de 2 dm3/s a 500 K. Calcule la concentración a la entrada de este gas, CA0, y la velocidad de flujo molar alimentada, FA0.
Objeto: Determinar la concentración a la entrada del gas (CA0) y la velocidad de flujo molar alimentada (FA0).


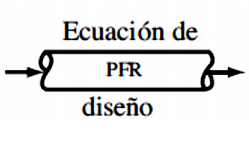
Ecuaciones de diseño para PFR (Reactor de Flujo Tapón)
El modelo del PFR considera que el fluido se desplaza como tapón, es decir, sin gradientes radiales de concentración, temperatura o velocidad de reacción.

EJEMPLO
Problema
Considerare la isomerización isotérmica en fase gas
A⎯→ B
En el laboratorio se determina la velocidad de una reacción química en función de la conversión del reactivo A. Las mediciones de laboratorio que se proporcionan en la tabla muestran la velocidad de reacción química en función de la conversión. La temperatura fue de 500 K (440°F), la presión global de 830 kPa (8.2 atm) y la carga inicial al reactor fue A puro.






Ecuaciones de diseño para PBR (Reactor Empacado)
Los reactores empacados son reactores tubulares llenos con partículas de catalizador.


Reactores en Serie
A veces los reactores están conectados en serie de modo que la corriente de salida de un reactor es la corriente de alimentación del siguiente, al usar este arreglo a menudo es posible acelerar los cálculos.
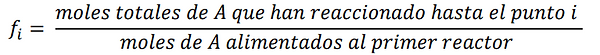
La velocidad de flujo molar de A, en el punto i es igual a los moles de A alimentados al primer reactor menos todas las moles de A que han reaccionado, hasta el punto i.

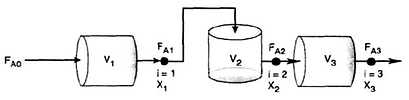
Reactor CSTR en serie:

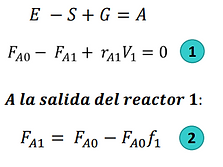

Segundo reactor la velocidad de desaparición de A −𝑟𝐴2 𝑠𝑒 𝑒𝑣𝑎𝑙ú𝑎 𝑝𝑎𝑟𝑎 𝑙𝑎 𝑐𝑜𝑛𝑣𝑒𝑟𝑠𝑖ó𝑛 𝑑𝑒 𝑙𝑎 𝑐𝑜𝑟𝑟𝑖𝑒𝑛𝑡𝑒 𝑑𝑒 𝑠𝑎𝑙𝑖𝑑𝑎 𝑑𝑒𝑙 𝑟𝑒𝑎𝑐𝑡𝑜𝑟 2, 𝑓2



Reactor PFR en serie:
Notamos que el volumen total de dos CSTR conectados en serie es menor que el volumen total de una sola conversión de CSTR, pero este no es el caso de la serie PFR. Vemos que ambas posiciones se pueden conectar en serie o utilizar reactores de flujo pistón continuo para alcanzar el volumen total del reactor requerido por el reactor.
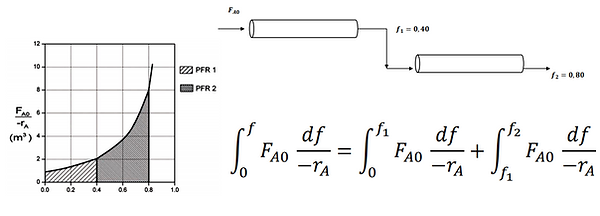
Combinaciones de CSTR y PFR en serie:
La secuencia final que debemos considerar es la combinación de CSTR, PFR en serie

LAS LEYES DE VELOCIDAD Y ESTEQUIOMETRÍA
Leyes de velocidad

Velocidad de reacción relativa
Las velocidades de reacción relativas de las diversas especies involucradas en una reacción pueden obtenerse por la relación de sus coeficientes estequiométricos. Para la reacción vemos que por cada mol de A que se consume, aparecen c/a moles de C. En otras palabras:
Velocidad de formación de (velocidad de desaparición de A)
La relación puede expresarse directamente por la estequiometria de la reacción,


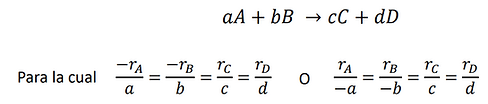
El orden de reacción y la ley de velocidad
La ley de velocidad o expresión cinética, indica la relación entre la velocidad de reacción y las concentraciones de las especies.
Para muchas reacciones, puede escribirse como el producto de una 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒 𝑑𝑒 𝑣𝑒𝑙𝑜𝑐𝑖𝑑𝑎𝑑 𝑑𝑒 𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 𝑘𝐴, y una función de las concentraciones (actividades) de las diversas especies que participan en la reacción:

Modelos de ley de potencia y leyes de velocidad elementales
La dependencia de la velocidad de reacción, −𝑟𝐴, en las concentraciones de las especies presentes, fn 𝐶𝑗 , casi sin excepción es determinada por observación experimental.
Una de las formas generales más comunes de esta dependencia es el modelo de ley de potencia.
En la ecuación, la reacción es de orden 𝛼:, con respecto al reactivo A, y de orden 𝛽, con respecto al reactivo B. El orden global de la reacción, n, es:
Las unidades de la constante de velocidad de reacción específica son:
Por consiguiente, las leyes de velocidad que corresponden a reacciones de orden cero, de primer orden, de segundo orden y de tercer orden, así como las unidades típicas para las constantes de velocidad correspondientes, son:



